60 років тому з науковців, які започаткували технологію, що дала вакцини від COVID-19, глузували колеги
Щоб зробити найшвидші в історії вакцини, насправді знадобилися десятиліття. Троє науковців не уявляли, що колись їхнє відкриття використають для терапії чи вакцини й що колись сам 90-літній Мезелсон питатиме про вакцину на основі власного відкриття.
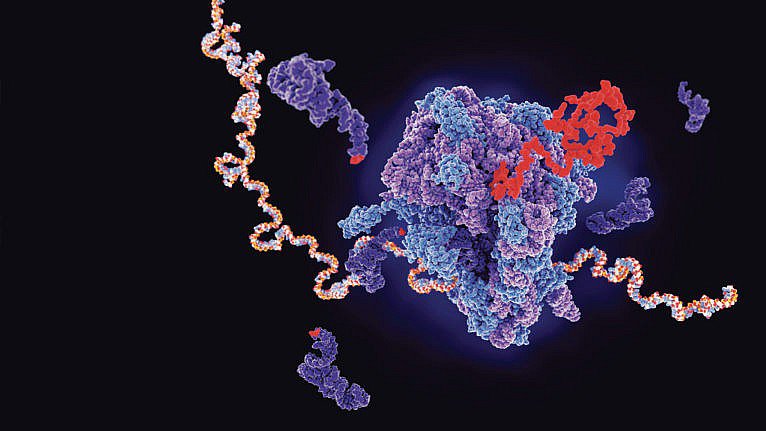
Про це йдеться у статті канадського журналу Maclean's. Наводимо скорочений та дещо адаптований переклад:
За кілька днів до Різдва 90-літній гарвардський професор з молекулярної біології Метью Мезелсон подзвонив у відділ охорони здоров'я Гарварду дізнатися щодо вакцини від Covid-19. Він дуже хотів отримати свій укол. Мезелсон почувався у своїй квартирі в Кембриджі, штат Массачусетс, як в ув'язненні. Лише за кілька кварталів від кампуса, де він пропрацював шість десятиліть. На початку 2020 року він офіційно вийшов на пенсію після викладання – проте продовжував свої дослідження, наскільки це було можливо, впродовж усієї пандемії, працюючи у своїй лабораторії в масці K95.
Він прагнув знову мати зв'язок зі світом навколо. Йому бракувало щотижневої вечері з найближчими друзями в ресторані – вони перейшли на Zoom, але витріщатися в екран – не те саме, що чекати на страву за накритим столом. Він сумував за Жанною Гілмен, з якою був одружений 32 роки та яка померла від раку наприкінці 2019-го. Мезелсон іще не зрозумів, як жити у світі без неї – й ізоляція зробила це завдання ще важчим.
Однак людина по той бік лінії вибачилася перед професором: "Ми ще не маємо розкладу вакцинації".
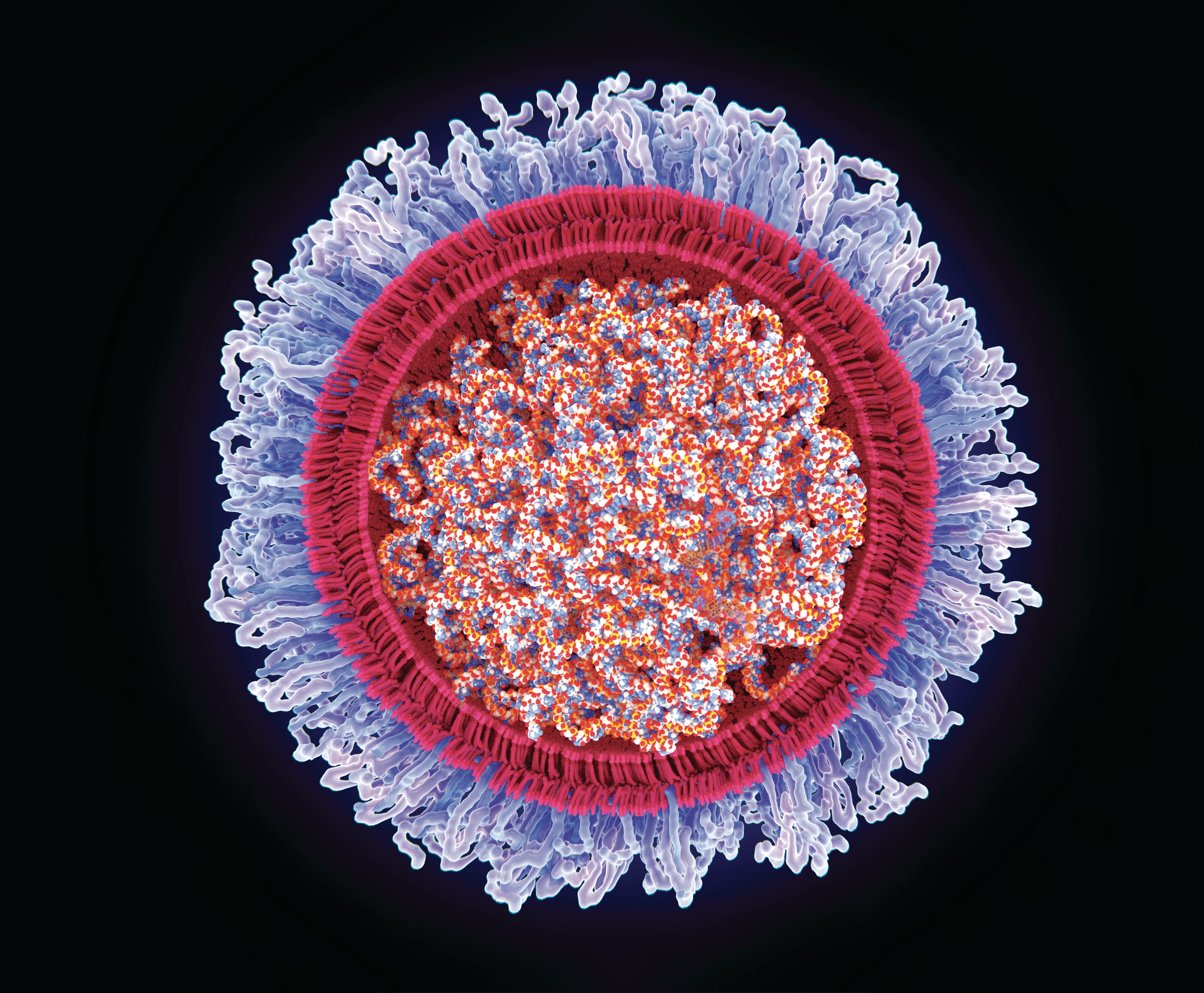
Перші дві вакцини від COVID-19 розробили, протестували та поширили настільки швидко, що багато державних служб іще не знали, як із ними поводитися. Вакцини від Pfizer-BioNTech та Moderna – перші в історії схвалені вакцини, які використовують модифіковану матричну РНК, яка міститься всередині ліпідної оболонки:
Реконструкція вихідного коду вакцини BioNTech/Pfizer від ковіду
Ця мРНК проникає в клітину і передає інструкцію щодо того як клітинам утворювати спайковий білок (той самий шип, який знаходиться на поверхні вірусу SARS-CoV-2). Клітина починає виробляти спайкові білки, а наша імунна система реагує на них як на вірус. SARS-CoV-2. Вакцини функціонують майже як поліційне оголошення "Увага! Розшук!": якщо побачите цих поганих хлопців – не пропустіть їх. Сама мРНК, надавши інструкції, деградує, не залишаючи власних слідів.
щоб зробити найшвидші в історії вакцини, насправді знадобилися десятиліття
Той факт, що мРНК є основою цих вакцин, і допоміг розробити їх настільки швидко. New York Times у листопаді повідомила про те, що вже через два дні після надання Китаєм генетичної послідовності вірусу SARS-CoV-2 науковці з Moderna Inc., компанії, що налічує лише десять років, розташованої в тому-таки Кембриджі, штат Массачусетс, де й Гарвардський університет і квартира Мезелсона, "ввела ці дані у свої комп'ютери та створила модель вакцини на основі мРНК". Тим часом маленька німецька компанія BioNTech, яка доти працювала над вакцинами від грипу на основі мРНК разом із фармацевтичним гігантом Pfizer, так само переспрямувала свої ресурси на створення іншої мРНК вакцини – від COVID.
Однак, щоб зробити ці найшвидші в історії вакцини, насправді знадобилися десятиліття. Вони є продуктом поколінь науковців, які одну ідею додавали до іншої, попередньої, та продовжували роботу, попри провальні експерименти, заперечення, загрози депортації, брак фінансування, скептицизм з боку сучасників.
Їх надихнув винахід ДНК: у 1951 році молода англійка Розалінд Франклін зробила рентгенівські фотографії, що зафіксували знамениту гвинтоподібну форму ДНК. Через два роки Джеймс Вотсон і Френсіс Крік із Кембриджського університету вперше описали подвійну спіраль ДНК, за що згодом здобули Нобелівську премію. (Розалінд Франклін померла від раку яєчників у 1958 році, її внесок упродовж її часу значною мірою було недооцінено).
Цих науковців штовхала вперед не гонитва наввипередки зі смертельним патогеном або шанс отримати патент на багато мільярдів доларів, а те, що штовхає вперед багатьох науковців: велике питання "Що таке життя"?
Це були не люди, які хочуть вирішувати маленькі проблеми, каже Мезелсон. Це були люди, які хотіли розв'язати велику проблему.
Він і сам був одним із таких.
***
Мезелсон народився в Колорадо в 1930-му. Вже у 16 років його взяли в університет Чикаго. У віці 27 років, під час навчання на постдокторській програмі в Каліфорнійському технологічному інституті (Caltech), Мезелсон разом зі своїм однолітком Френком Сталем продемонстрували, як саме відтворюється ДНК. Історик науки Фредерік Голмс пізніше опише цю роботу як "найгарніший біологічний експеримент", який показав, як працює життя.
Проте залишалося чимало відкритих питань про те, що відбувається всередині наших клітин. Мезелсон і його колеги знали, що ДНК перебуває в ядрі – відділі, забарикадованому від решти клітини за допомогою мембрани. По інший бік цієї мембрани – цитоплазма, желатиноподібна рідина, що заповнює решту клітини. Й усередині неї перебувають крихітні гранули, що називаються рибосомами, й вони своєю чергою містять у собі РНК.
Приблизно в той самий час, коли Мезелсон і Стал опублікували свою проривну роботу щодо ДНК, французькі науковці виявили, що клітини будують протеїни через рибосоми. ДНК, яка містить у собі ключові коди життя, є відносно пасивною молекулою. Рибосоми ж роблять щоденну роботу, створюючи протеїни, які здійснюють біологічні процеси виживання. Питання: як?
Один із цих французьких науковців, доктор Франсуа Жакоб, висловив припущення, що має існувати "нестабільний посередник" між ДНК та РНК, який пересилає повідомлення-команди від першої до другої, а потім зникає.
Жакоб – лікар, якого виключили з медичного університету, коли в 1940 році Німеччина захопила Францію, провів воєнні роки в армії опору Шарля де Голля.
Він назвав теоретичного посередника невибагливо: "Ікс". Інші дослідники "закочували очі", коли він представляв свою теорію, згадує Жакоб у своїх мемуарах. "Ще трохи, й моя аудиторія зафукала б мене й пішла б", – писав він.

Навесні 1960 року Жакоб написав Мезелсону, пропонуючи, що він та Сідні Бреннер – південноафриканський біолог із Кембриджського університету – спільно в лабораторії Мезелсона в Caltech пошукали цього "Ікса".
Мезелсон, який тоді викладав лише перший рік, на той час уже розробив технологію з відстеження дрібніших молекул усередині клітин. Жакоб вважав, що ця техніка зможе виявити й ідентифікувати "Ікса". Того літа, за участі Жакоба та Бреннера, Мезелсон висіяв перші культури.
За операції відповідав Бреннер, а Жакоб записував, бо мусив сидіти: біль від уламків снаряду в обох його ногах посилився через вогкий каліфорнійський клімат.
Три тижні один експеримент провалювався за іншим. Рибосоми розвалювалися. Інші науковці періодично пропихали голови в лабораторію й саркастично питали про "містера Ікс". Жакоб пише, що вони "приходили подивитися, як приходять у зоопарк". В останній день експерименту Мезелсон, здавшись, поїхав геть – у Бостон, робити пропозицію своїй першій дружині.
Жакоб і Бреннер у відчаї пішли на пляж Малібу. Вони лежали на піску, спостерігаючи за велетенськими хвилями Тихого океану, які розбивались на лінії прибою, й міркуючи про те, де ж вони помилилися. Жакоб у мемуарах пише: "Зненацька Сідні... підстрибує і верещить: Магній! Це через магній!" Вони просто з пляжу побігли в лабораторію, додали магнію – й результат був разючим. "Посланець Ікс" існує.
Того-таки дня пара продемонструвала в Каліфорнійському технологічному інституті цього "Ікса". І навіть тоді їм ніхто не повірив.
Вони зв'язались із Мезелсоном, який уже долетів у Бостон. Той був у захваті.
Коли наступного року тріо опублікувало свої результати, вони перейменували цього "посланця Ікс" на "РНК-посланця", англійською messenger RNA, українською – інформаційна РНК, або частіше, щоб скорочення було тим самим – матрична РНК.
Та сама мРНК, яка тепер є основою вакцин від COVID-19.
Вони не уявляли, що колись їхнє відкриття використають для терапії чи вакцини й що колись сам 90-літній Мезелсон питатиме про вакцину на основі власного відкриття. (Жакоб помер у віці 92 років у 2013-му, Бреннер також дожив до 92 років і помер у 2019-му).
Тоді їхні питання були більш, так би мовити, філософськими. Мезелсон згадує: "Нас цікавило, що ж дозволяє з простих атомів періодичної частини утворити щось живе".
Їхня праця стала основою молекулярної біології: ДНК утворює РНК, яка утворює протеїни, які утворюють життя.
Їхня праця стала основою молекулярної біології: ДНК утворює РНК, яка утворює протеїни, які утворюють життя.
Потрібно було ще покоління науковців, щоб знайти спосіб приручити РНК для лікування та запобігання хворобі.
***
Каталін Каріко дитиною в Кішуйсаллаші спостерігала, як її батько, м'ясник, розчленовує свинячі туші. Це було її перше зіткнення з наукою.
Вивчаючи біохімію в університеті Сегеда у 1970-х, Каріко почула про нове відкриття з Лондона: інтерферон – протеїн, який утворює тіло для запуску захисту від вірусу, запускається за допомогою типу РНК, що називається 2-5A. Каріко пригадує, як учитель розповів їй про це відкриття і як він був у захваті від можливостей, які воно дає. Він пояснив їй, що створивши синтетичну версію молекули 2-5A, можна буде лікувати рак або вірусні хвороби. Це стало для неї початком 40-літнього квесту зі створення синтетичної РНК задля лікування хвороб.
Проте вона не змогла знайти фінансування в Угорщині. Одружена, з маленькою донькою, Каріко не бачила майбутнього у власній країні. Вона писала професорам у лабораторії по всій Європі, проте ніхто не міг узяти її на роботу. Нарешті, через майже десяток років, у 1985-му, вона отримала пропозицію з університету Темпл у Філадельфії. Якщо вона зможе дістатись у США – там на неї чекає робоче місце.
Угорські гроші в той час не можна було законно конвертувати в іншу валюту або ж вивезти з країни. Переживаючи про те, як дожити до першої зарплатні, Каріко з чоловіком продали свою радянську машину і на чорному ринку обміняли гроші на 900 британських фунтів. Купюри зашили в іграшкове ведмежа своєї доньки. До речі, власниця ведмежати, в якому контрабандою вивозили з соцтабору валюту, згодом стала дворазовою чемпіонкою Олімпійських ігор із веслування.

Після приїзду все пішло не за планом. Керівництво Каріко змінилось, їй не надали фінансування, вона втратила роботу. Новий начальник подавав документи на її депортацію.
Відчайдушно прагнучи залишитись у США, де її донька пішла в перший клас, Каріко прийняла посаду в місцевості Бетесда, штат Мериленд. Вона виїжджала з Філадельфії о третій ночі в понеділок на роботу. Поверталася додому пізно ввечері у п'ятницю.
У Бетесді вчена спала у колег або в офісі, щоб не винаймати ще одне житло. Вихідними вона привозила додому лабораторне обладнання, щоб чоловік його відремонтував. "Якби хтось подивився на мене ззовні, вони б відчули запах поту й боротьби за виживання", – каже вона.
Тим часом синтетична РНК виявилась "головняком". У всьому світі науковці стикалися з тією самою проблемою: клітини в чашах Петрі помирали.
Коли такий вірус, як-от коронавірус, вводить у людське тіло власні нуклеїнові кислоти – ДНК чи РНК – ці нуклеїнові кислоти своїми командами змушують тіло відтворювати вірус. Таким чином вірус інфікує не одну клітину, а всю людину (чи тварину). Інфекцію можливо зупинити, коли клітина ідентифікує вторгнення й, замість відтворювати вірус, спрямовує проти нього свої антивірусні сили, низку імунних клітин.
"Імунна клітина розпізнає: О Боже, нас атакують! І терміново повідомляє всі інші клітини: Сюди, тут вороги!" – пояснює Каріко.
У найбільш екстремальних випадках клітина здійснює своєрідне альтруїстичне самогубство, знищуючи себе, щоб запобігти безконтрольному зараженню решти організму. Саме це й відбувалося в лабораторіях, коли дослідники вводили у клітини синтетичну РНК. Смерть клітин через самогубство.
Каріко, яка у 1990 році перейшла до університету Пенсильванії, була переконана, що можливо якось обійти цей механізм і дозволити створити РНК, яка плавно входитиме у клітину, не запускаючи у відповідь атаку з боку захисних сил клітини. Були докази, що це можливо: дослідники з університету Вісконсину в 1990 році успішно ввели РНК в живих мишей.
Того-таки року Каріко подала заявку на грант щодо розробки генної терапії на основі мРНК. У фінансуванні було відмовлено. Відхилили й наступні заявки. А без фінансування – її змістили з посади.
Проте вона лишалась переконаною. "Я завжди почувалася Кассандрою", – каже вона, посилаючись на відому віщунку в грецькій міфології, яка мала дар пророцтва, проте їй не вірили через прокляття.
Каріко не вміла "продавати" ідеї. Вона це визнає. "Я не могла отримати гроші: я не вміла переконувати людей".
Станом на 1997 рік Каріко годинами сиділа біля робочого ксерокса, копіюючи роздруківки з наукових журналів, щоб читати вдома. Там, біля ксерокса, вона й зустріла лікаря-імунолога доктора Дрю Вайсмана. Вони почали говорити про свою роботу. Вайсман був новим співробітником, щойно після постдокторської стипендії в Національному інституті охорони здоров'я, де його науковим керівником був нині знаменитий на цілий світ через свою публічну посаду під час пандемії доктор Ентоні Фаучі.
Вайсман працював із дендритними клітинами – клітинами людського тіла, які поглинають частки патогенів і представляють залишки як доказ імунній системі.
Каріко й Вайсман вирішили співпрацювати.
За наступні десять років Каріко й Вайсман відкрили, що клітини в лабораторіях помирають, бо синтетична мРНК провокує запальний процес. Але якщо модифікувати один із чотирьох будівельних блоків РНК, відомих як нуклеозиди – то клітина більше не позначає синтетичну РНК як вторгнення ззовні. Можна ввести її в клітину, не спричинивши запалення. "Це все змінило в нашій галузі", – каже доктор Норберт Парді, доцент-дослідник в університеті Пенсильванії, який працює з Каріко та Вайсманом.
Дідусь Норберта Парді працював м'ясником разом із батьком Каріко в Угорщині – й він попросив у неї бути науковою керівницею, коли був студентом, іще там, удома. Зрештою він став самостійним дослідником мРНК і згодом слідом за Каріко виїхав до США. Працюючи з Каріко та Вайсманом, Парді виявив, що якщо запакувати мРНК в обгортку з ліпідних наночастинок, то мРНК можна таким чином захистити від швидкого зникнення після введення в організм, що робить її більш ефективною.
Вайсман і Каріко відразу зрозуміли, що їхнє спільне відкриття має велетенський потенціал. "Зазвичай, коли хтось винаходить нові ліки – вони працюють лише проти однієї хвороби, – каже Вайсман. – Але РНК мало потенціал діяти проти багатьох різних хвороб". Вони вважали, що мРНК може працювати як вакцина, терапія чи система зміни генів: "Вона може лікувати сотні, якщо не тисячі, різних хвороб".
Їхнє відкриття було опубліковано в журналі Immunity у 2005 році – й на їхнє розчарування, наукова спільнота не помітила статтю. Втім, вони відкрили компанію під назвою RNARx, яка отримала скромні як на США гранти для дрібного бізнесу на загальну суму трохи менше за $1 млн від уряду США.
Проте компанія так і не злетіла: університет обмежує ліцензування інтелектуальної власності, отриманої під час роботи на нього.
На запитання, чи розізлив його такий бізнес-результат, Вайсман знизує плечима: "Думати про минуле немає сенсу, оскільки ти не можеш його ані змінити, ані виправити. Сталося так, як сталося".
***
Отримавши два перші ступені в університеті Торонто, канадський уродженець Дерік Россі от-от мав закінчити й докторантуру, проте оголосив, що кидає й переїжджає до Парижа. "Вони думали, що я збожеволів", – каже Россі. Він провів у Франції рік, допізна працюючи в дослідницькій лабораторії й ходячи на вечірки у вільний час.
Звільнився, коли більше не міг витримати такий темп. Проїхав автостопом по Європі. Провів певний час за дослідницькою роботою в Техасі. Переїхав тепер уже до Фінляндії, з третьої спроби закінчивши докторантуру у віці під сорок.
На той час дослідження стовбурових клітин стало гарячим політичним питанням: американські консерватори вимагали заблокувати федеральне фінансування досліджень, які використовували клітини, отримані з ненароджених ембріонів.
Деріка Россі заінтригувала робота японського дослідника Сінья Яманаки, яка, здавалося, допомагала обійтися без ембріональних стовбурових клітин. Яманака відкрив, що зрілі клітини можна обернути назад на стовбурові за допомогою чотирьох транскрипційних чинників, тепер відомих як фактори Яманаки – за це він здобув Нобелівську премію.
Та є одне "але", й дуже серйозне. Яманака вводив ці транскрипційні фактори у клітину за допомогою ретровірусів. Ця стратегія не спрацює на людях. Ретровіруси, чудово доставляючи в собі такий вантаж, як транскрипційні фактори, можуть інтегруватися в ДНК клітини й залишитися там назавжди, пояснює Россі.
Він почав замислюватися, чи може функцію служби доставки виконувати мРНК. І знову повернулася та сама проблема: клітини, що гинуть у чашах Петрі.

Шукаючи рішення, Россі й натрапив на непомічене науковою спільнотою відкриття Каріко та Вайсмана, якому на той час було майже три роки.
лапи мишей починали світитися в пітьмі
У першому експерименті із застосуванням цього підходу Россі й аспірант Ліор Зангі створили модифіковану мРНК люциферази, ензиму світлячків, який дозволяє їм випромінювати світло.
Модифіковану мРНК люциферази впорскували в ноги мишам під наркозом – і лапи мишей починали світитися в пітьмі.
"Спрацювало з першого ж разу. Це багато чого каже про життєздатність технології", – згадує Россі.
Наслідки експерименту та все, що випливає, були йому очевидні: модифікована мРНК дозволяє швидко створювати протеїн – можливо, будь-який протеїн. Незалежно від того, чи він буде потрібен для лікування хвороби чи запобігання їй.
Россі став у 2010-му співзасновником компанії, яка до 2020 року була маловідомою, але від 2020-го є однією з найвідоміших у світі. Вона називається Moderna.
Дерік Россі – харизматичний оповідач, який добре вміє пояснювати складні наукові концепції за допомогою простих слів. І він переконав гігантів біотехнологій США інвестувати в його компанію. Через кілька років функціонування "поза межами досяжності радарів", у 2013 році Moderna оголосила, що невдовзі запровадить у фармацевтичний арсенал цілком нову категорію ліків.
За наступні два роки після того Moderna Therapeutics залучила майже мільярд доларів приватних інвестицій – суму, яку New York Times назвав "доволі визначною" для компанії, що на той час навіть не мала експериментального препарату, який проходив би клінічні випробування.
***
Кожна людина має у своєму тілі сотні мільйонів примірників мРНК, які розсилають інструкції щодо критичної для життя діяльності всередині наших клітин.
мРНК у вакцинах відрізняється від нашої звичайної мРНК у двох аспектах:
- вона створена в машинах, а не в ядрі клітин
- вона проникає у клітину ззовні.
Але щойно мРНК з вакцини опиняється всередині – вона робить абсолютно те саме, що й наша мРНК: рибосоми читають її повідомлення й починають працювати, будуючи відповідні білки.
У випадку вакцини від COVID-19, клітини починають будувати спайковий протеїн вірусу SARS-CoV-2. Наші тіла навчаються розпізнавати цей протеїн як вторгнення – й ставлять нашу імунну систему на сигналізацію.
Пересуваючись по світу, заходячи в супермаркети, церкви та школи, ми, не знаючи того, вперше зіткнемось із вірусом. Якщо ми вакциновані – наша імунна система вже знає, як на це відповісти.
***
Acuitas Therapeutics із міста Ванкувер створює ліпідні системи доставки (обгортки) для кількох видів терапевтичних препаратів, включно з вакциною на основі мРНК від Pfizer-BioNTech та ще однієї, яка досі проходить випробування – німецької CureVac. Голова ради директорів Acuitas Томас Медден порівнює ліпідну упаковку для мРНК із захисною обгорткою тендітних ялинкових прикрас: в ідеалі її знімають безпосередньо перед тим, як повісити прикрасу на ялинку. Для вакцин на основі мРНК стійка до впливу середовища система доставляння означає, що для того, щоб мРНК спрацювала, потрібна менша доза. "Ми можемо вакцинувати значно більшу кількість людей за допомогою певної кількості вакцини, якщо система доставки високоефективна", – каже Медден.
чи знаємо ми всі побічні ефекти?
Переваги вакцин на основі мРНК вражають: немає ризику справжнього зараження, як у випадку вакцинації вірусом. Немає змін у геномі. мРНК швидко деградує, не залишаючи по собі нічого, крім інструкцій. Вакцину можна "порахувати" на комп'ютері та швидко створити для виробництва.
В останні чотири роки стрімко зростала цікавість до вакцин на основі мРНК, і вже йшла робота над щепленнями від раку, грипу, Еболи, Зіка.
Залишаються й питання. Скільки часу триватиме захист? Чи усуває він також ризик передачі? Які саме існують ризики у плані побічних ефектів – і чи знаємо ми їх всі?

Коли почалося полювання на вакцину від COVID, упродовж місяців дозріли плоди десятиліть досліджень. Цей процес прискорили надання інфраструктури та фінансова підтримка з боку урядів усього світу.
Й уже в листопаді як Moderna, так і Pfizer-BioNTech повідомили про результати третьої фази клінічних випробувань, які показали, що обидві вакцини захищають на понад 90% від гострих форм хвороби, спричиненої SARS-CoV-2.
Науковці, які розмовляли з журналом Maclean's, називали 9 листопада – день, коли Pfizer-BioNTech оголосили про дані випробувань – яскравою точкою в році, що був жахливий загалом. "Результати стали для всіх вибухом мозку", – каже Вайсман, який втратив через COVID-19 кількох друзів.
Медден почув результати у Ванкувері вранці по радіо BBC й написав про них усім у своїй компанії, де працюють 29 людей. (Останній рік позмінно, щоб дотримуватися соціальної дистанції в лабораторії). Компанія розіслала всім службою доставки шампанське.
Пандемія спричинила "повноліття" вакцин на основі мРНК, каже Медден.
Той факт, що перші схвалені урядами вакцини є саме новітніми, створеними на основі мРНК, показує, що цю технологію можна швидко й ефективно застосовувати проти майбутніх загроз, каже він. І додає, що сподівається на полегшення розповсюдження вакцини Pfizer-BioNTech у найближчі кілька місяців. Нинішня вимога зберігати їх при -70°C була пов'язана з необхідністю прискорити схвалення – тестування стабільності вакцини на нижчих температурах вимагало б затримки. Ці дослідження тривають, зазначає він.
Каріко, яка почала працювати в BioNTech у 2014 році, та Вайсман уже є кандидатами на Нобелівську премію, враховуючи їхню проривну наукову діяльність, яка допомогла створити нові вакцини. Каріко каже, що її нагороди не мотивують. "Мені важлива одна річ: що ця вакцина зупиняє інфекцію".
Каріко та Вайсман отримали першу з двох необхідних доз у Філадельфії 18 грудня – їх обох щепили вакциною Pfizer-BioNTech.
Россі поки що чекає на свою чергу й каже, що з задоволенням прийме будь-яку зі схвалених урядом вакцин.
Медден у Ванкувері теж чекає на свою чергу разом із рештою населення Канади. Він також радо прийме будь-яку вакцину – хоча хотів би, щоб це була якась із тих, що використовують ліпідну обгортку, створену його компанією.
Мезелсон у Бостоні працює над теорією, що процес старіння спричиняють пов'язані з окисненням ушкодження. Він почав учитися грати на віолончелі через FaceTime і перечитує неопубліковані праці своєї покійної дружини. Вона була видатною антропологинею, яка викрила таємну лабораторію біологічної зброї в СРСР як джерело спалаху смертельної сибірської виразки. Один із близьких друзів Мезелсона помер у Британії від COVID-19 у квітні, через місяць після їхньої останньої зустрічі.
Знаменитий науковець вважає, що вакцини є ключовою частиною відповіді на цю пандемію – проте не можуть бути єдиною.
Для запобігання майбутнім пандеміям, каже він, будуть життєво необхідними належна вентиляція та фільтрація повітря в закритих приміщеннях.
А тим часом він нетерпляче очікує на день свого щеплення.

